Versauerung des Ozeans
Das andere CO2-Problem: Das vom Menschen emittierte Kohlendioxid erwärmt nicht nur die Atmosphäre, sondern lässt die Weltmeere saurer werden, mit unabsehbaren Folgen für zahlreiche Lebewesen im Meer.Ozean Versauerung
Das andere CO2-Problem
Es ist weitgehend bekannt, dass Kohlendioxid (CO2) die Hauptursache für den durch den Menschen verursachten Klimawandel ist. Das durch die Verbrennung fossiler Energieträger vom Menschen emittierte CO2 ist in der Atmosphäre ein strahlungsaktives Gas und verstärkt den Treibhauseffekt durch die Absorption langwelliger Strahlung. Nicht das gesamte anthropogenen Kohlendioxids verbleibt jedoch in der Atmosphäre, ein Teil wird von der Vegetation aufgenommen und ein anderer Teil gelangt in den Ozean. Für die Pflanzen ist das zusätzliche CO2 von Nutzen, da es das Wachstum befördert. Im Ozean stellt es jedoch ein gewaltiges Problem dar: Der Ozean versauert. Und das ist für zahlreiche Lebewesen im Meer schädlich, vor allem für diejenigen, die Kalkschalen bilden. Das Ozeanwasser ist inzwischen so sauer wie seit 20 Mio. Jahren nicht mehr.1
Zwar gab es auch in früheren Zeiten der Erdgeschichte schon eine starke Versauerung des Meerwassers durch zusätzliches Kohlendioxid, so während des Paläozän/Eozän-Temperaturmaximums (in der Fachwelt als PETM abgekürzt) vor etwa 50 Millionen Jahren.1 Die Versauerung lief damals jedoch wesentlich langsamer ab, so dass der Ozean Zeit hatte, das zusätzliche CO2 in tiefere Schichten zu mischen. Das ist heute nicht möglich. Der rapide zunehmende CO2-Gehalt der Atmosphäre und damit des Ozeans führen dazu, dass sich die Versauerung in schnellem Tempo im Oberflächenwasser der Weltmeere ausbreitet. Auch am Ende der letzten Eiszeit stieg der CO2-Gehalt der Atmosphäre und damit des Ozeans stark an. Im Vergleich zu dieser Zeit nimmt das Oberflächenwasser der Meere gegenwärtig das zusätzliche Kohlendioxid der Atmosphäre jedoch 100 Mal schneller auf.6
Der Prozess der Versauerung
Die Atmosphäre tauscht CO2 mit dem Ozean durch die Differenz im CO2-Partialdruck zwischen Ozean und Atmosphäre aus. Ist der atmosphärische CO2-Druck in der Atmosphäre höher als der des Ozeans, wird Kohlendioxid im Oberflächenwasser des Ozeans gelöst. Der CO2-Partialdruck im Ozean hängt stark von der Temperatur ab, d.h. er steigt und sinkt mit der Temperatur. Ein kühlerer Ozean nimmt daher mehr CO2 aus der Atmosphäre auf als ein wärmerer Ozean.
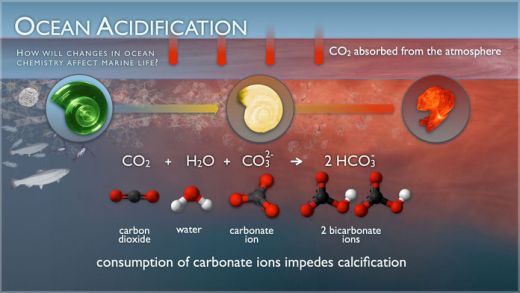
Abb. 1: Die Graphik zeigt die Bildung von Kohlensäure aus der Reaktion von CO2 mit Wasser und Karbonat-Ionen. Dabei werden Karbonat-Ionen verbraucht, wodurch als Folge die Bildung von Kalk erschwert wird bzw. Kalkschalen sich auflösen.9
In der Atmosphäre ist Kohlendioxid chemisch inaktiv, d.h. es geht keine Verbindungen mit anderen Gasen ein. Ganz anders verhält sich CO2 jedoch im Meerwasser. Fast das gesamte darin gelöste CO2 geht Verbindungen mit anderen Stoffen ein.2 Wenn CO2 sich in Meerwasser löst, reagiert es mit Wasser und bildet Kohlensäure (H2CO3):
CO2 + H2O -> H2CO3
Die Kohlensäure wiederum spaltet sich auf in H+-Ionen und Hydrogenkarbonat-Ionen (HCO3-):
H2CO3 -> H+ + HCO3-
Ein weiterer Effekt ist, dass die Zunahme der H+-Ionen dazu führt, dass sich ein Teil der Karbonat-Ionen (CO32-) im Wasser mit den H+-Ionen zu Hydrogenkarbonat-Ionen (HCO3-) verbindet:
H+ + CO32- -> HCO3-
Die Zunahme von H+ „verbraucht“ also Karbonat. Der Nettoeffekt der Lösung von CO2 in Meerwasser ist also eine Erhöhung der Konzentration von Kohlensäure, Wasserstoff-Ionen und Hydrogenkarbonat-Ionen, während die von Karbonat-Ionen sinkt. Karbonat-Ionen werden jedoch zur Bildung von Kalziumkarbonat (CaCO3) benötigt, dem Baustein von Kalkskeletten und –schalen z.B. von Korallen, Muscheln, Schnecken und Seeigeln.
Die Ozeanversauerung wird an der H+-Konzentration in mol pro Liter festgemacht und durch den pH-Wert bestimmt. Der pH-Wert steht zur H+-Konzentration in einem negativ logarithmischen Verhältnis. Wenn H+ um das 10fache zunimmt (z.B. von 0,01 auf 0,1), nimmt der pH-Wert um 1 Einheit ab (in diesem Fall von 2 auf 1). In reinem Wasser, das weder sauer noch basisch, sondern neutral ist, beträgt der pH-Wert 7. Die Konzentration von H+ ist 10-7 in mol pro Liter.7 Im Ozean ist der pH-Wert leicht basisch und lag vorindustriell bei 8,2, heute bei 8,1.3 Diese Abnahme des pH-Wertes um 0,1 entspricht einer Zunahme der H+-Konzentration von 6,3 x 10-9 auf 7,9 x 10-9 bzw. um 26 %.4
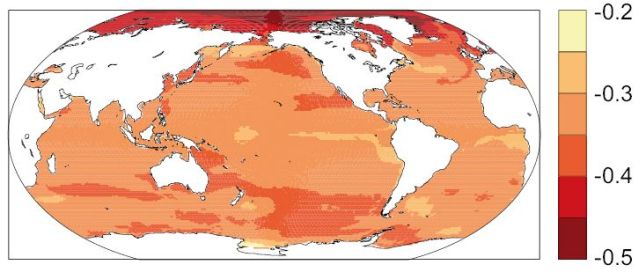
Abb. 2: Änderungen des pH-Wertes im Oberflächenwasser von den 1990er Jahren bis in die 2090er Jahre nach dem RCP8.5-Szenario
Ein entscheidender Faktor bei der Ozeanversauerung ist die Sättigung des Ozeanwassers mit Karbonat-Ionen (CO32-). Das Oberflächenwasser der Ozeane ist normalerweise mit Karbonat-Ionen übersättigt, d.h. es ermöglicht die Bildung von Kalkschalen und –skeletten. In den tieferen Schichten, ab 1-2 km und tiefer, herrscht von Natur aus eine Untersättigung vor, weshalb sich hier Kalk auflöst. Die Grenze dazwischen ist der sog. Sättigungshorizont bzw. die Lysokline, unter der die Auflösung von Kalk beginnt, während darüber Kalk gebildet wird.
Das Kalziumkarbonat (CaCO3) der Schalentiere besteht hauptsächlich aus zwei Sorten, Kalzit und Argonit. Kalzit, das sich in den Schalen von Muscheln, einigen Korallen, Seeigeln, Seesternen und Muscheln findet, löst sich schwerer auf als Aragonit, mit dem die meisten Korallen ihre Kalbestandteile aufbauen. Der Sättigungshorizont für die Bildung von Kalzit liegt daher in größeren Tiefen als der von Aragonit. Die Ozeanversauerung lässt den Sättigungshorizont beider Kalkarten nach oben wandern. So wird geschätzt, dass der Sättigungshorizont von Kalzit und Aragonit seit dem 19. Jahrhundert um 50-200 m angehoben wurde. Die Folge ist, das immer mehr kalkbildende Organismen in untersättigte Schichten geraten, wo ihre Kalkschalen durch Auflösung gefährdet sind. Besonders gefährdet sind die Kalkschalen im Arktischen und im Südlichen Ozean. Hier wird der Sättigungshorizont am Ende dieses Jahrhunderts wahrscheinlich die Oberfläche erreichen. Aber auch im Nordatlantik wird er bis dahin von unter 2000 m auf 100 m ansteigen.6; 8
Hinter der Abnahme des pH-Wertes seit Beginn der Industrialisierung steckt eine Emission von 555 GtC in die Atmosphäre durch menschliche Aktivitäten. Davon hat der Ozean etwa 155 GtC Kohlenstoff aufgenommen. Für das Ende des 21. Jahrhunderts wird mit einer weiteren Absenkung des pH-Wertes um 0,2 bis 0,4 gerechnet.5 Der stärkste Rückgang wird in der Arktis erwartet, wo der pH-Wert nach dem Szenario RCP8.5 bis um 0,5 sinken könnte. Der Grund ist die hohe Aufnahme von CO2 durch das kalte Wasser des Arktischen Ozeans.
Anmerkungen:
1. Kerr, R.A. (2010): Ocean Acidification. Unprecedented, Unsettling, Science 328, 1500-1501
2. The Royal Society (2005): Ocean acidification due to increasing atmospheric carbon dioxide
3. The Royal Society (2005): Ocean acidification due to increasing atmospheric carbon dioxide
4. IPCC (2013): Climate Change 2013, Working Group I: The Science of Climate Change, 3.8.2
5. IPCC (2013): Climate Change 2013, Working Group I: The Science of Climate Change, FAQ 3.3
6. Ocean Acidification Reference User Group (2010). Ocean Acidification: Questions Answered. Laffoley, D. d’A., and J.M. Baxter (eds). European Project on Ocean Acidification (EPOCA). Dt. Übersetzung online
7. AMAP (2013): AMAP Assessment 2013: Arctic Ocean Acidification. Arctic Monitoring and Assessment Programme (AMAP)
8. Secretariat of the Convention on Biological Diversity (2014): An Updated Synthesis
of the Impacts of Ocean Acidification on Marine Biodiversity (Eds: S. Hennige, J.M. Roberts & P. Williamson). Montreal, Technical Series No. 75
9. Quelle: NOAA PMEL Carbon Program: Ocean Acidification; Lizenz: NOAA public domain: Use of Data and Products
